4.6 Conductividad Eléctrica y Polaridad. (Electrolitos y No Electrolitos)




Como se mencionó anteriormente, cuando un soluto covalente como la glucosa (C6H12O6) o la sucralosa es disuelto en agua, lo que ocurre es un proceso de hidratación de las moléculas de agua con la molécula covalente, sin formar iones que actúen como transportadores de corriente eléctrica. Esta hidratación se representa como:


La conductividad eléctrica la podemos definir como la capacidad de un cuerpo, de permitir el
| |
paso de la corriente eléctrica a través de si. La conductividad eléctrica puede presentarse en los diferentes estados de la materia, como el estado líquido, sólido y gaseoso. A continuación, solo se considerará las disoluciones acuosas, que utilizan agua líquida como solvente.
La Conductividad en este tipo de disolución está relacionada con la presencia de solutos iónicos en el disolvente, cuya disociación genera iones positivos y negativos capaces de transportar la corriente eléctrica a través de la solución.
Podemos dividir a los solutos en dos categorías: electrolitos y no electrolitos. Un electrolito es una sustancia que al disolverse en agua se disocia o separa en sus correspondientes iones (especias químicas que presentan carga positiva o negativa), formando una disolución que conduce la corriente eléctrica. Dicha disolución, se conoce como disolución electrolítica. Un soluto del tipo no electrolito, es una sustancia no conductora de la corriente eléctrica, debido a que no genera iones, constituyendo parte de una disolución no electrolítica. Por ejemplo, la glucosa, la sacarosa y la sucralosa (edulcorante) son compuestos covalentes que en disolución acuosa no conducen la electricidad. Recuerda que un compuesto que esta formado por enlaces covalentes, constituye un compuesto covalente.
La Conductividad en este tipo de disolución está relacionada con la presencia de solutos iónicos en el disolvente, cuya disociación genera iones positivos y negativos capaces de transportar la corriente eléctrica a través de la solución.
Podemos dividir a los solutos en dos categorías: electrolitos y no electrolitos. Un electrolito es una sustancia que al disolverse en agua se disocia o separa en sus correspondientes iones (especias químicas que presentan carga positiva o negativa), formando una disolución que conduce la corriente eléctrica. Dicha disolución, se conoce como disolución electrolítica. Un soluto del tipo no electrolito, es una sustancia no conductora de la corriente eléctrica, debido a que no genera iones, constituyendo parte de una disolución no electrolítica. Por ejemplo, la glucosa, la sacarosa y la sucralosa (edulcorante) son compuestos covalentes que en disolución acuosa no conducen la electricidad. Recuerda que un compuesto que esta formado por enlaces covalentes, constituye un compuesto covalente.
Dependiendo del grado de disociación, los electrolitos se clasifican como electrolitos fuertes, los cuales se disociación completamente, y electrolitos débiles (disociación parcial). La figura 2 ilustra una manera simple, para determinar si un soluto es electrolito o no. Dos láminas metálicas, como cobre o platino (que actúan como electrodos positivos y negativos) son introducidas en agua pura o destilada. Para que la ampolleta se encienda debe haber un flujo de corriente eléctrica desde un electrodo a otro, para cerrar el circuito. El primer caso, donde representa agua pura con los electrodos, se evidencia que la ampolleta no enciende, ya que el agua pura es un mal conductor de la corriente eléctrica. Sin embargo, si se agrega una pequeña cantidad de un electrolito, como el cloruro de sodio (NaCl, que es un compuesto iónico) se encenderá la ampolleta, debido a que el compuesto se disocia en iones sodio (Na+) y iones cloruro (Cl-), generando una disolución electrolítica, como lo muestra la figura 2c.
Dicha disolución, en donde el compuesto se disocia casi en su totalidad en Na+ y Cl- en el disolvente agua, constituyendo un electrolito fuerte, se puede representar como:
Donde el cloruro de sodio sólido al reaccionar con agua líquida, se disocia en iones positivos Na+ y iones negativos Cl-. Dado que el compuesto se disocia en un alto grado, el movimiento de una gran cantidad de iones Na+ hacia el electrodo negativo (-) y de los iones Cl- al electrodo positivo (+), genera una gran conducción eléctrica en la disolución generando una disolución electrolítica. Por consiguiente, se dice que el NaCl es un electrolito fuerte.
En el caso donde se agrega un electrolito que se disocia parcialmente como es una solución de ácido acético con agua al 4%, formando una menor cantidad de especies cargadas, la conducción eléctrica será inferior, por consiguiente se dice que es un electrolito débil. Por lo tanto se representa como:
Donde co-existen las especies moleculares y los iones acetato (CH3COO-) e hidronio (H3O+), formando un equilibrio químico. La formación de los iones permite que circule la corriente eléctrica a través del circuito, encendiendo la ampolleta con menor intensidad. La disminución de la intensidad se debe a que el ácido no se disocia completamente, quedando la especie molecular CH3COOH.
| |
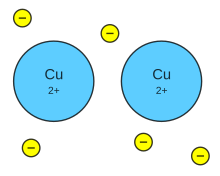
El agua es un solvente polar (presenta un extremo
positivo y otro negativo, formando polos) muy
eficaz para compuestos iónicos (ver figura 3).
El proceso en el que un ión se rodea de
moléculas de agua, distribuidas en una forma
especifica, se denomina hidratación, como
se ilustra en la figura 4.
positivo y otro negativo, formando polos) muy
eficaz para compuestos iónicos (ver figura 3).
El proceso en el que un ión se rodea de
moléculas de agua, distribuidas en una forma
especifica, se denomina hidratación, como
se ilustra en la figura 4.
Como se mencionó anteriormente, cuando un soluto covalente como la glucosa (C6H12O6) o la sucralosa es disuelto en agua, lo que ocurre es un proceso de hidratación de las moléculas de agua con la molécula covalente, sin formar iones que actúen como transportadores de corriente eléctrica. Esta hidratación se representa como:
Donde la glucosa se disuelve en agua como una molécula neutra, en lugar de formar iones que conduzcan la electricidad. Algunos alcoholes y azucares son no electrolitos. En la siguiente tabla se muestran algunos electrolitos fuertes y débiles y no electrolitos.
4.7 Enlace Covalente Coordinado.
Este enlace se presenta cuando uno de los átomos cede el
par de electrones que comparten entre dos, el otro átomo sólo aporta su orbital
vacío para acomodarlos. Ejemplos de sustancias con este tipo de enlace se
muestran en la tabla 4.7.
Tabla 4.7 Moléculas con enlace covalente coordinado Nombre
Fórmula Ión
hidronioH3O+Ión
amonioNH4+Ácido
sulfúricoH2SO4
Ácido clóricoHClO
3Ácido nítricoHNO3
4.8 Enlace Metálico.
Estos átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras muy compactas. Se trata de líneas tridimensionales que adquieren estructuras tales como: la típica de empaquetamiento compacto de esferas (hexagonal compacta), cúbica centrada en las caras o la cúbica centrada en el cuerpo.
En este tipo de estructura cada átomo metálico está dividido por otros doce átomos (seis en el mismo plano, tres por encima y tres por debajo). Además, debido a la baja electronegatividad que poseen los metales, los electrones de valencia son extraídos de sus orbitales. Este enlace sólo puede estar en sustancias en estado sólido.1
Los metales poseen algunas propiedades características que los diferencian de los demás materiales. Suelen ser sólidos a temperatura ambiente, excepto el mercurio, y tienen un punto de fusión alto.
El enlace metálico es característico de los elementos metálicos. Es un enlace fuerte, primario, que se forma entre elementos de la misma especie. Al estar los átomos tan cercanos unos de otros, interaccionan sus núcleos junto con sus nubes electrónicas, empaquetándose en las tres dimensiones, por lo que quedan los núcleos rodeados de tales nubes. Estos electrones libres son los responsables de que los metales presenten una elevada conductividad eléctrica y térmica, ya que estos se pueden mover con facilidad si se ponen en contacto con una fuente eléctrica. Los metales generalmente presentan brillo y son maleables. Los elementos con un enlace metálico están compartiendo un gran número de electrones de valencia, formando un mar de electrones rodeando un enrejado gigante de cationes. Muchos de los metales tienen puntos de fusión más altos que otros elementos no metálicos, por lo que se puede inferir que hay enlaces más fuertes entre los distintos átomos que los componen. La vinculación metálica es no polar, apenas hay diferencia de electronegatividad entre los átomos que participan en la interacción de la vinculación (en los metales, elementales puros) o muy poca (en las aleaciones), y los electrones implicados en lo que constituye la interacción a través de la estructura cristalina del metal. El enlace metálico explica muchas características físicas de metales, tales como maleabilidad, ductilidad, buenos en la conducción de calor y electricidad, y con brillo o lustre (devuelven la mayor parte de la energía lumínica que reciben).
La vinculación metálica es la atracción electrostática entre los átomos del metal o cationes y los electrones deslocalizados. Esta es la razón por la cual se puede explicar un
4.9 Enlace por Puente de Hidrógeno.
Enlace por puente de hidrógeno: Es una atracción que existe entre un átomo de hidrógeno (carga positiva) con un átomo pequeño muy electronegativo, como flúor(F), oxígeno (O) o nitrógeno (N) ( F-H, O-H, N-H ), que posee un par de electrones libres (carga negativa), de ahí el nombre de "enlace de hidrógeno", que no debe confundirse con un enlace covalente a átomos de hidrógeno). Un puente de hidrógeno es en realidad una atracción dipolo-dipolo entre moléculas que contienen esos tres tipos de uniones polares.
Este tipo de atracción tiene solamente una tercera parte de la fuerza de los enlaces covalentes, pero tiene importantes efectos sobre las propiedades de las sustancias en que se presentan, especialmente en cuanto a puntos de fusión y ebullición en estructuras de cristal.
4.10 Enlace por Fuerzas Intermoleculares o de Vander Waals.
En fisicoquímica, las fuerzas de Van der Waals o interacciones de Van der Waals, son las fuerzas atractivas o repulsivas entre moléculas (o entre partes de una misma molécula) distintas a aquellas debidas a un enlace intramolecular (Enlace iónico, Enlace metálico y enlace covalente de tipo reticular) o a la interacción electrostática de iones con otros o con moléculas neutras.1 El término incluye:
- Fuerza entre dos dipolos permanentes. Si las interacciones son entre moléculas que están polarizadas de manera permanente (por ejemplo, las moléculas de agua que atraen otras moléculas de agua u otras moléculas polares), se conocen como fuerzas de Keesom.
- Fuerza entre un dipolo permanente y un dipolo inducido. Cuando un dipolo inducido (esto es, un dipolo que se induce en un átomo o una molécula que de otra manera sería no polar) interactúa con una molécula que tiene un momento dipolar permanente, esta interacción se conoce como fuerza de Debye. Un ejemplo de esta interacción serían las fuerzas entre las moléculas de agua y las de tetracloruro de carbono.
- Fuerza entre dos dipolos inducidos instantáneamente. Si las interacciones son entre dos dipolos que están inducidos en los átomos o moléculas, se conocen como fuerzas de London (por ejemplo, el tetracloruro de carbono).
También se usa en ocasiones como un sinónimo para la totalidad de las fuerzas intermoleculares.
Comentarios
Publicar un comentario